Contrôle qualitéEssais de cytotoxicité
Clean Cells a développé un essai de «potency » innovant et répondant aux exigences des Autorités Réglementaires. La méthode peut être utilisée pour la caractérisation in vitro des activités d’ADCC, de CDC et/ou d’apoptose des anticorps.
Spécificités et bénéfices de l’essai Clean Cells
Une prise en compte du cadre règlementaire
Tous nos essais sont développés en prenant en compte les lignes directrices et recommandations des différentes autorités de régulation :
- Ph. Eur. General monograph : Monoclonal antibodies for human use, 2008
- EMA:
- USP chapters <1032> Design and Development of Biological Assays, <1033> Biological Assay Validation and <1034> Analysis of Biological Assays
- FDA Point to consider in the manufacture and testing of monoclonal antibody products for human use, feb. 1997 [http://www.fda.gov/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation/OtherRecommendationsforManufacturers/default.htm]
- ICH:
Une méthode non radioactive innovante de mesure de la cytotoxicité
Des essais d’activité biologique (« potency ») standardisés et représentatifs des mécanismes d’action sont requis par les Autorités Règlementaires pour la caractérisation des anticorps thérapeutiques. Dans le cas des anticorps anti-tumoraux, tels que MabThera® ou Herceptin®, la significativité biologique va reposer sur une mesure de la mort des cellules cibles, à travers des essais d’ apoptose, d’ADCC (cytotoxicité cellulaire dépendante des anticorps) et/ou de CDC (cytotoxicité dépendante du complément).
Bien que la méthode de libération du 51Cr soit considérée comme l’une des plus spécifiques et sensibles pour évaluer la cytotoxicité, celle-ci est très difficile à mettre en œuvre dans un contexte industriel en raison des contraintes liées à l’usage de la radioactivité. Les méthodes alternatives non radioactives disponibles (par exemple, la calcéine ou la LDH) souffrent en général d’un manque de sensibilité, de reproductibilité et/ou de spécificité. Enfin, quelle que soit la méthode choisie, les essais de cytotoxicité sont généralement considérés, au même titre que les autres bio-essais, comme ayant des performances limitées en terme de standardisation.
En partant de ces observations, Clean Cells a développé une méthode non radioactive, basée sur la luminescence, qui :
- est spécifique du mécanisme d’action des anticorps cytolytiques (c-à-d mesurant la lyse de la cellule cible) ;
- présente un potentiel de standardisation amélioré, grâce à l’utilisation d’une molécule reportrice stablement exprimée par les cellules cibles (pas d’étape de marquage requise);
- est facile à implémenter grâce à l’utilisation d’équipements courants (luminomètres).
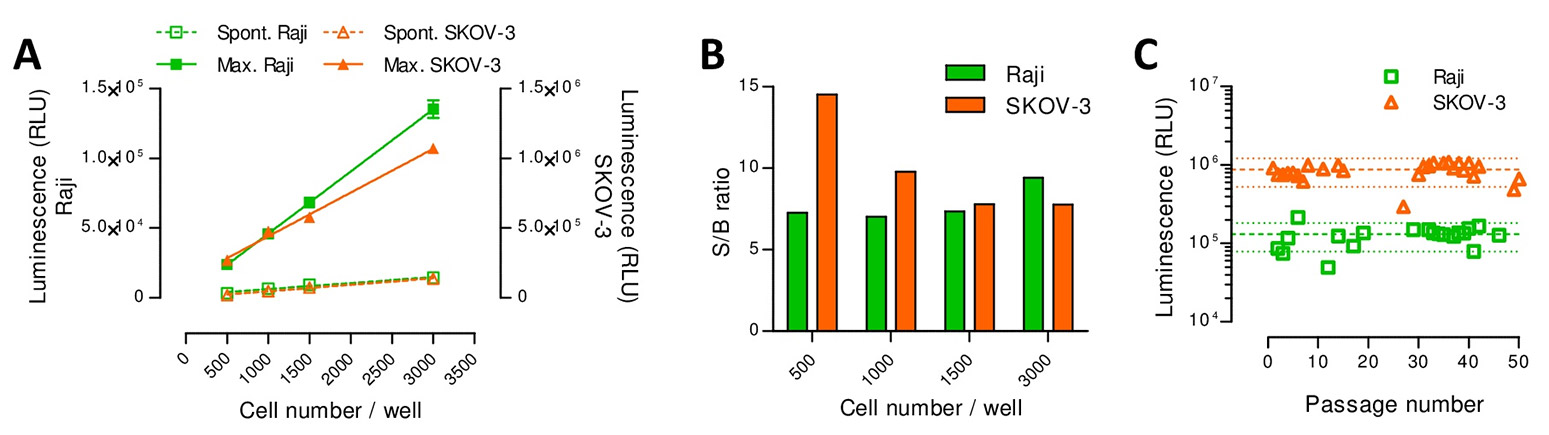
La méthode est basée sur la transformation génétique de cellules cibles pour leur faire exprimer une protéine reportrice, qui est ensuite libérée dans le surnageant de culture lors de la mort des cellules. Comme illustré sur la figure 1, la méthode génère un signal linéaire et très sensible, permettant d’utiliser moins de 1000 cellules/puits. De plus, l’expression de la protéine reportrice est très stable au cours du temps.
Figure 1. (A) Les signaux de relargages maximum et spontané sont proportionnels au nombre de cellules cibles/puits (Raji ou SKOV-3) (moyenne±ET de triplicats et régression linéaire). La lyse maximale est obtenue en présence de Triton X-100. (B) Des ratios signal/bruit (S/B) forts et reproductibles sont mesurés en utilisant des quantités de cellules cibles allant de 500 à 3000 /puits. (C) La stabilité de l’expression de la protéine reportrice a été suivie sur 50 passages (les lignes pointillées représentent la médiane ± 40%, respectivement).
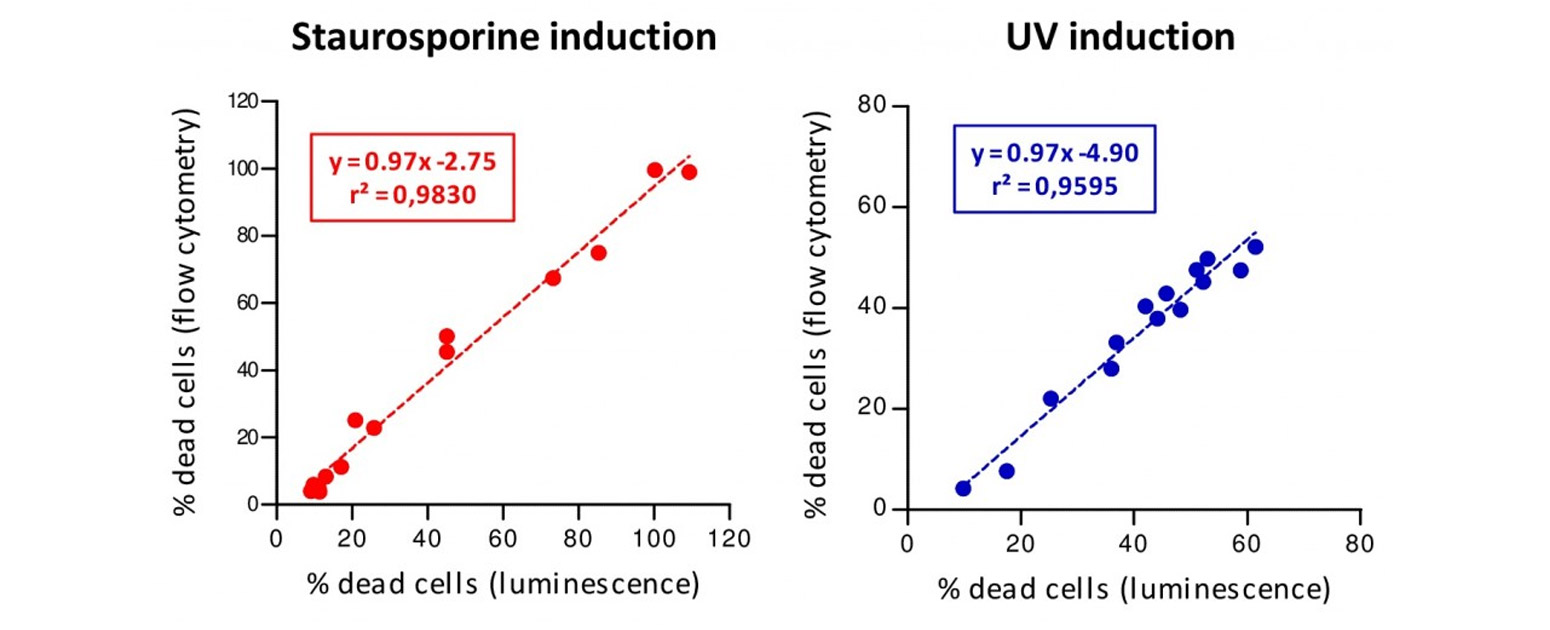
De plus, en induisant l’apoptose grâce à un agent chimique (staurosporine) ou par exposition aux UV, une corrélation quasi-parfaite est observée entre la libération de la protéine reportrice et la mort réelle des cellules (mesurée par cytométrie en flux), comme montré sur la figure 2. Ces données démontrent que la méthode est parfaitement représentative de la mort des cellules cibles.
Figure 2. Des cellules Raji transformées ont été cultivées en présence de concentrations croissantes de staurosporine (rouge) ou exposées à des doses croissantes d’UV (bleu). Dans chaque puits, le pourcentage de cellules mortes a été calculé en mesurant le signal luminescent dans le surnageant et, en parallèle, dans les culots cellulaires par cytométrie en flux via un marqueur vital. Les lignes pointillées indiquent les régressions linéaires calculées à partir de ces données (n=2 expériences indépendantes).
Des cellules effectrices développées spécialement pour standardiser les essais d’ADCC
Les essais d’ADCC sont généralement considérés comme des essais très variables. L’origine de la cellule effectrice peut être considérée comme la principale source de variabilité. Ainsi, en utilisant des cellules mononucléées du sang périphérique (PBMC) issues de donneurs humains, la variabilité de l’essai va être impactée par une forte variabilité inter-individuelle, liée à l’existence de polymorphismes génétiques (par exemple le polymorphisme FCGR3A-158). En plus de présenter une variabilité fonctionnelle liée aux conditions de culture, les lignées de cellules NK (par ex. NK92) vont en outre fréquemment souffrir d’un fort niveau de lyse non spécifique à cause de l’expression de récepteurs NK à leur surface.
Grâce à une collaboration avec l’INSERM¹, Clean Cells produit des cellules effectrices d’ADCC standardisées, consistant en des lymphocytes T cytotoxiques humains transformés pour exprimer le récepteur CD16 humain (FcγRIIIa, avec une valine en position 158). Ces cellules sont médiatrices d’ ADCC² et présentent les avantages suivants :
- une absence complète de lyse non spécifique, contre n’importe quelle cible (pas d’expression de récepteurs NK);
- pas de variabilité inter-individuelle dans la réponse ADCC car tous les lots sont produits à partir d’une même banque cellulaire originelle;
- des lots de cellules très homogènes produits dans un format « décongeler-et-utiliser » et une activité ADCC très reproductible entre les lots garantissent des résultats stables et reproductibles au cours du temps.
¹INSERM UMR892, Nantes (France), under licence for INSERM, Université d’Angers, Université de Nantes and Centre National de la Recherche Scientifique.
²Clémenceau et al. Blood 2006. 107:4669-4677.
Comme illustré par la courte vidéo ci-dessous, les cellules effectrices sont très actives sur le tapis de cellules cibles en présence de l’anti-CD20 MabThera® comparativement à la présence d’un anticorps non relevant [les changements de couleurs bleu>vert>rouge symbolisent des flux calciques croissants dans les cellules]. Les cellules effectrices « criblent » la couche de cellules cibles, se fixent sur une cellule cible donnée lorsque celle-ci porte du MabThera® à sa surface et activent alors le processus cytolytique, aboutissant à une contraction de la cible et à sa mort.
Ces cellules effectrices de l’ADCC sont de parfaits candidats pour le développement de tout type d’essai d’ADCC, quelle que soit la méthode de lecture envisagée (51Cr, LDH, calcéine, Europium, mesure de la prolifération, etc.). Bien évidemment, elles sont parfaitement adaptées à la méthode luminescente développée par Clean Cells !
Performances de la méthode et comparaison avec celle du 51Cr
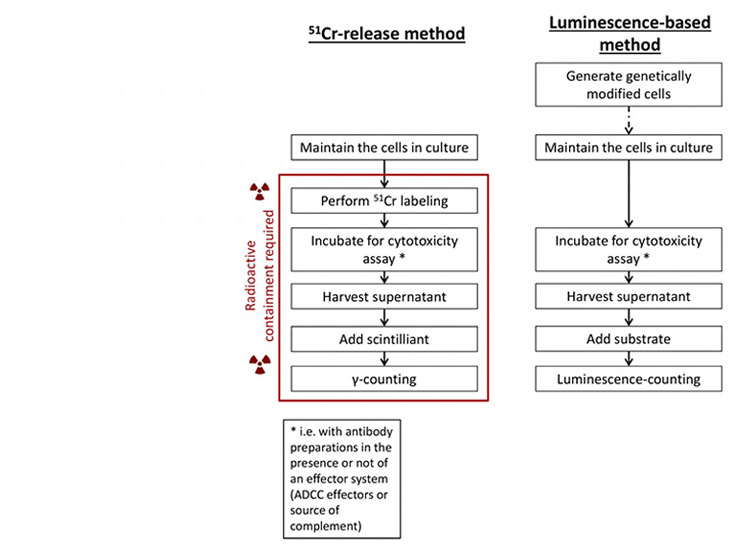
Les procédures expérimentales associées aux deux méthodes sont comparées sur le schéma temporel suivant.
Cette comparaison montre tout d’abord que la méthode luminescente requiert moins de manipulations, réduisant ainsi le risque de variabilité et le temps expérimental nécessaire.
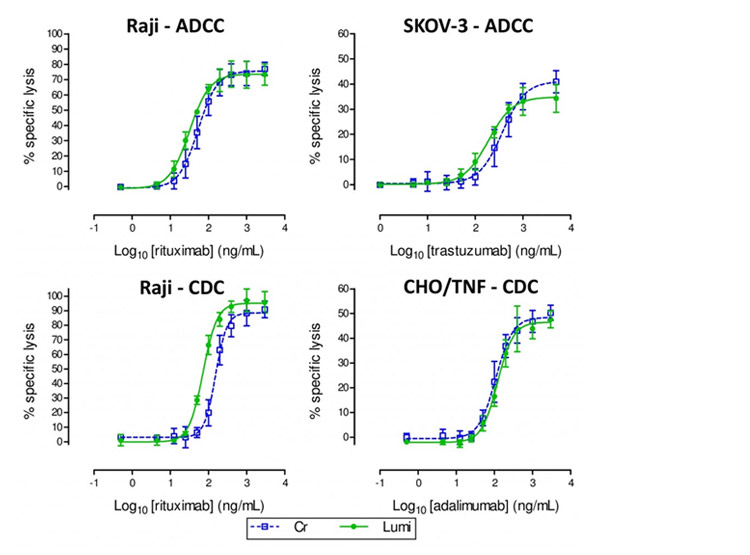
Dans une série d’expériences comparatives réalisées en parallèle, la méthode luminescente montre des résultats de lyse entièrement comparables à ceux de la méthode au 51Cr, comme l’illustrent la Figure 3 et les données caractéristiques de la régression logistique à 4 paramètres présentées dans le Tableau 1. En association avec les cellules effectrices d’ADCC standardisées de Clean Cells, l’essai atteint une très bonne précision intermédiaire (CV des EC50).
Tableau 1. Les valeurs moyennes des ratios S/B, des Emin, des Emax et des EC50 avec les coefficients de variation (CV) correspondants sont reportés pour les essais d’ADCC et de CDC, obtenues avec les méthodes luminescentes ou au 51Cr dans les différents modèles. Les données sont issues de 3 essais indépendants.
| Essai | Modèle | Méthode | S/B ratio | Emin (moyenne) | Emax (moyenne) | EC50 (ng/mL) [CV] |
| ADCC | Raji | 51Cr | 5.6 | -1.2 % | 75.7 % | 55.7 [29.3%] |
| Lumi. | 17.1 | -1.2 % | 73.6 % | 31.8 [22.8%] | ||
| SKOV-3 | 51Cr | 4.4 | 0.4 % | 41.2 % | 387.7 [38.4%] | |
| Lumi. | 13.6 | 0.1 % | 35.1 % | 191.6 [7.2%] | ||
| CDC | Raji | 51Cr | 3.0 | 3.0 % | 88.6 % | 156.7 [19.2%] |
| Lumi. | 5.7 | -0.3 % | 95.6 % | 73.1 [13.5%] | ||
| CHO/TNF | 51Cr | 4.4 | -0.5 % | 47.9 % | 142.7 [18.6%] | |
| Lumi. | 7.9 | -2.2 % | 46.5 % | 152.5 [15.0%] |
Conclusion
La nouvelle méthode permet d’obtenir des résultats entièrement comparables à ceux de la méthode au 51Cr, le tout dans un format d’essai simple à mettre en œuvre et économique. Sa haute sensibilité nécessite ainsi peu de cellules (500 à 1000 cellules cibles /puits au minimum), compatible avec l’analyse haut débit (HTS).
Associée avec les cellules d’ADCC standardisées proposées par Clean Cells, la méthode démontre un potentiel de standardisation inédit pour ce genre d’essai, avec des performances amélioré par rapport au 51Cr.
La méthode est représentative du mécanisme d’action des anticorps. L’ensemble de ses caractéristiques la rend compatible avec les obligations règlementaires (par exemple EMA/CHMP/BWP/157653/07) et elle est pleinement utilisable for des essais d’ADCC, de CDC et d’apoptose.
La technologie est accessible à travers des prestations de services réalisées par Clean Cells ou via un transfert de technologie vers nos Clients. Les modèles actuellement disponibles sont les suivants (tout modèle à façon pouvant être développé par ailleurs) :
| Lignées cibles disponibles | Antigènes cibles testés | Exemples d’anticorps | Testé en ADCC | Testé en CDC | Testé en apoptose |
| Raji (lymphome B) | CD19, CD20 | MabThera® | Oui | Oui | Oui |
| SKOV-3 (ovaire) | EGFR, HER2 | Erbitux®, Herceptin® | Oui | Non | Oui |
| SKBR-3 (sein) | HER3 | (Résistante à la lyse) | |||
| CHO exprimant le TNF-α membranaire | TNF-α | Humira®, Remicade® | Oui | Oui | Oui |
Exemples d’utilisation
Comparaison de l’effet de modifications d’anticorps (niveau de fucose, changement de procédé de production, etc.) sur l’activité cytotoxique au cours du temps;
Mesure de la stabilité inter-lots durant le développement ou la production;
Évaluation de la biosimilarité;
Développement de tests d’activité biologique validés selon les BPF pour du contrôle qualité ou des tests libératoires sur des anticorps innovants ou biosimilaires.